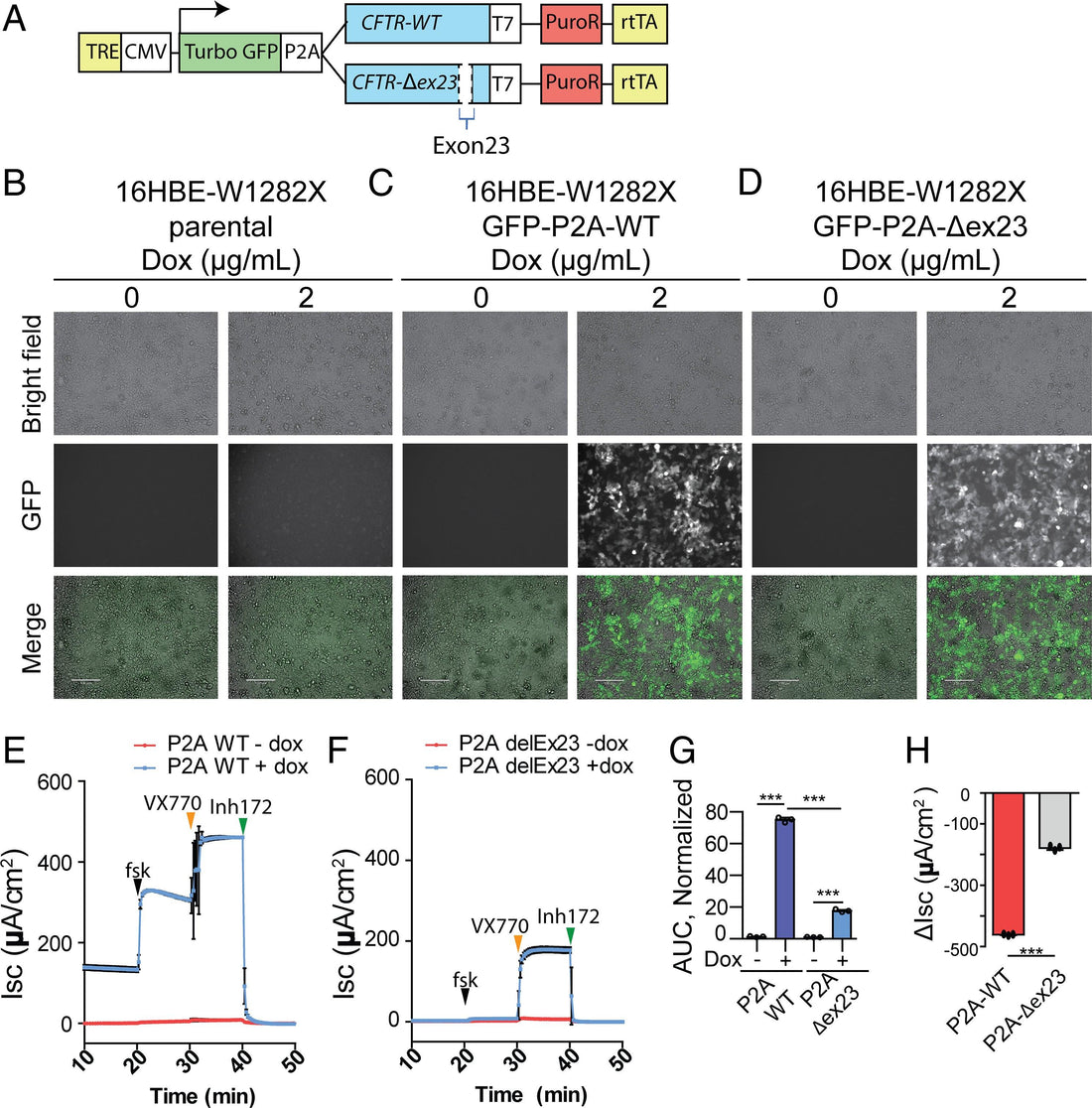
Le mutazioni nel gene del regolatore della conduttanza transmembrana della fibrosi cistica ( CFTR ) causano la fibrosi cistica (CF) e la mutazione nonsenso CFTR -W1282X causa una forma grave di FC. Sebbene Trikafta e altre terapie di modulazione del CFTR siano utili alla maggior parte dei pazienti con FC, manca una terapia mirata per i pazienti con la mutazione W1282X. La proteina CFTR-W1282X ha un'attività residua ma è espressa a un livello molto basso a causa del decadimento dell'RNA messaggero (mRNA) mediato dal nonsenso (NMD). La terapia di soppressione del NMD e la terapia read-through sono attivamente oggetto di ricerca per i mutanti nonsenso del CFTR . La soppressione del NMD potrebbe aumentare l'mRNA del CFTR mutante e le terapie read-through potrebbero aumentare i livelli della proteina CFTR a lunghezza intera. Tuttavia, questi approcci presentano limitazioni e potenziali effetti collaterali: poiché il meccanismo NMD regola anche l'espressione di molti mRNA normali, un'ampia inibizione del percorso non è auspicabile e i farmaci read-through sono inefficienti in parte perché il modello mRNA mutante è soggetto a NMD. Per aggirare questi problemi, abbiamo perseguito una strategia di oligonucleotidi antisenso (ASO) che saltano l'esone per ottenere un'evasione NMD specifica per gene. Un cocktail di due ASO che prendono di mira il sito di splicing ha indotto l'espressione di mRNA CFTR senza l'esone 23 contenente il codone di terminazione prematura (CFTR-Δex23), che è un esone in-frame. Il trattamento di cellule epiteliali bronchiali umane con questo cocktail di ASO che prendono di mira i siti di splicing che fiancheggiano l'esone 23 determina un salto efficiente dell'esone 23 e un aumento della proteina CFTR-Δex23. Il cocktail ASO splice-switching aumenta la corrente di cloruro mediata da CFTR nelle cellule epiteliali bronchiali umane. I nostri risultati preparano il terreno per lo sviluppo di una terapia allele-specifica per la FC causata dalla mutazione W1282X.
"Le cellule 16HBEge sono state coltivate come un monostrato elettricamente compatto su supporti filtranti Snapwell (Corning, 3801), come descritto ( 38 ), e sia le membrane sierose che mucose sono state esposte agli ASO per 4 giorni e ai correttori CFTR VX-809, VX-661 o VX-445 per 24 ore prima delle analisi (Selleckchem, S1565, S7059 e S8851, rispettivamente). Gli inserti Snapwell sono stati trasferiti in una camera di Ussing (P2302, Physiologic Instruments, Inc.). Solo il lato sieroso è stato superfuso con 5 mL di tampone salino fisiologico tamponato con HEPES [acido 4-(2-idrossietil)-1-piperazineetansolfonico]; sul lato della mucosa, sono stati utilizzati 5 mL di soluzione fisiologica tamponata con CF-HEPES (137 mM di Na-gluconato, 4 mM di KCl, 1,8 mM di CaCl 2 , 1 mM di MgCl 2 , 10 mM di HEPES e 10 mM di glucosio; pH regolato a 7,4 con N -metil- d -glucamina) per creare un gradiente di ioni cloruro transepiteliale. Dopo aver bloccato la tensione transepiteliale a 0 mV, la corrente di cortocircuito (I SC ) è stata misurata con un morsetto di tensione epiteliale Physiologic Instruments VCC MC6 mantenendo la temperatura del tampone a 37 °C. L'attività basale è stata registrata per 20 minuti prima che gli agonisti (concentrazioni finali: 10 µM forskolin [Sigma, F6886] e 10 µM VX-770 [Selleckchem, S1144]) e l'inibitore (concentrazione finale: 20 µM CFTRinh-172 [Sigma, C2992]) fossero applicati in sequenza a intervalli di 10 minuti sia sulle superfici sierose che su quelle mucose. Gli agonisti/inibitori sono stati aggiunti da 200× a 1.000× soluzioni madre. L'acquisizione dei dati è stata eseguita con ACQUIRE & ANALYZE Revision II (Physiologic Instruments)."
GUARDA L'ARTICOLO COMPLETO QUI: https://www.pnas.org/doi/10.1073/pnas.2114858118