Mutationen im Gen des Cystic Fibrosis Transmembrane Conductance Regulators ( CFTR ) verursachen Mukoviszidose (CF), und die CFTR -W1282X-Nonsense-Mutation verursacht eine schwere Form von CF. Obwohl Trikafta und andere CFTR-Modulationstherapien den meisten CF-Patienten helfen, fehlt eine gezielte Therapie für Patienten mit der W1282X-Mutation. Das CFTR-W1282X-Protein weist eine Restaktivität auf, wird jedoch aufgrund des Nonsense-vermittelten mRNA-Zerfalls (NMD) auf einem sehr niedrigen Niveau exprimiert. NMD-Unterdrückungstherapie und Read-Through-Therapie werden aktiv für CFTR- Nonsense-Mutanten erforscht. Die Unterdrückung von NMD könnte die mutierte CFTR- mRNA erhöhen, und Read-Through-Therapien könnten die Werte des CFTR-Proteins in voller Länge erhöhen. Diese Ansätze sind jedoch mit Einschränkungen und potenziellen Nebenwirkungen behaftet: Da der NMD-Mechanismus auch die Expression vieler normaler mRNAs reguliert, ist eine breite Hemmung des Signalwegs nicht wünschenswert. Zudem sind Read-Through-Medikamente teilweise deshalb ineffizient, weil die mutierte mRNA-Vorlage anfällig für NMD ist. Um diese Probleme zu umgehen, verfolgten wir eine Strategie mit Exon-skipping-Antisense-Oligonukleotiden (ASOs), um eine genspezifische NMD-Umgehung zu erreichen. Ein Cocktail aus zwei auf Spleißstellen ausgerichteten ASOs induzierte die Expression von CFTR- mRNA ohne das Exon 23 (CFTR-Δex23), das ein vorzeitiges Terminationscodon enthält und ein In-Frame-Exon ist. Die Behandlung menschlicher Bronchialepithelzellen mit diesem Cocktail aus ASOs, die auf die Spleißstellen neben Exon 23 abzielen, führt zu einem effizienten Überspringen von Exon 23 und einem Anstieg des CFTR-Δex23-Proteins. Der Splice-Switching-ASO-Cocktail erhöht den CFTR-vermittelten Chloridstrom in menschlichen Bronchialepithelzellen. Unsere Ergebnisse legen den Grundstein für die Entwicklung einer allelspezifischen Therapie für CF, die durch die W1282X-Mutation verursacht wird.
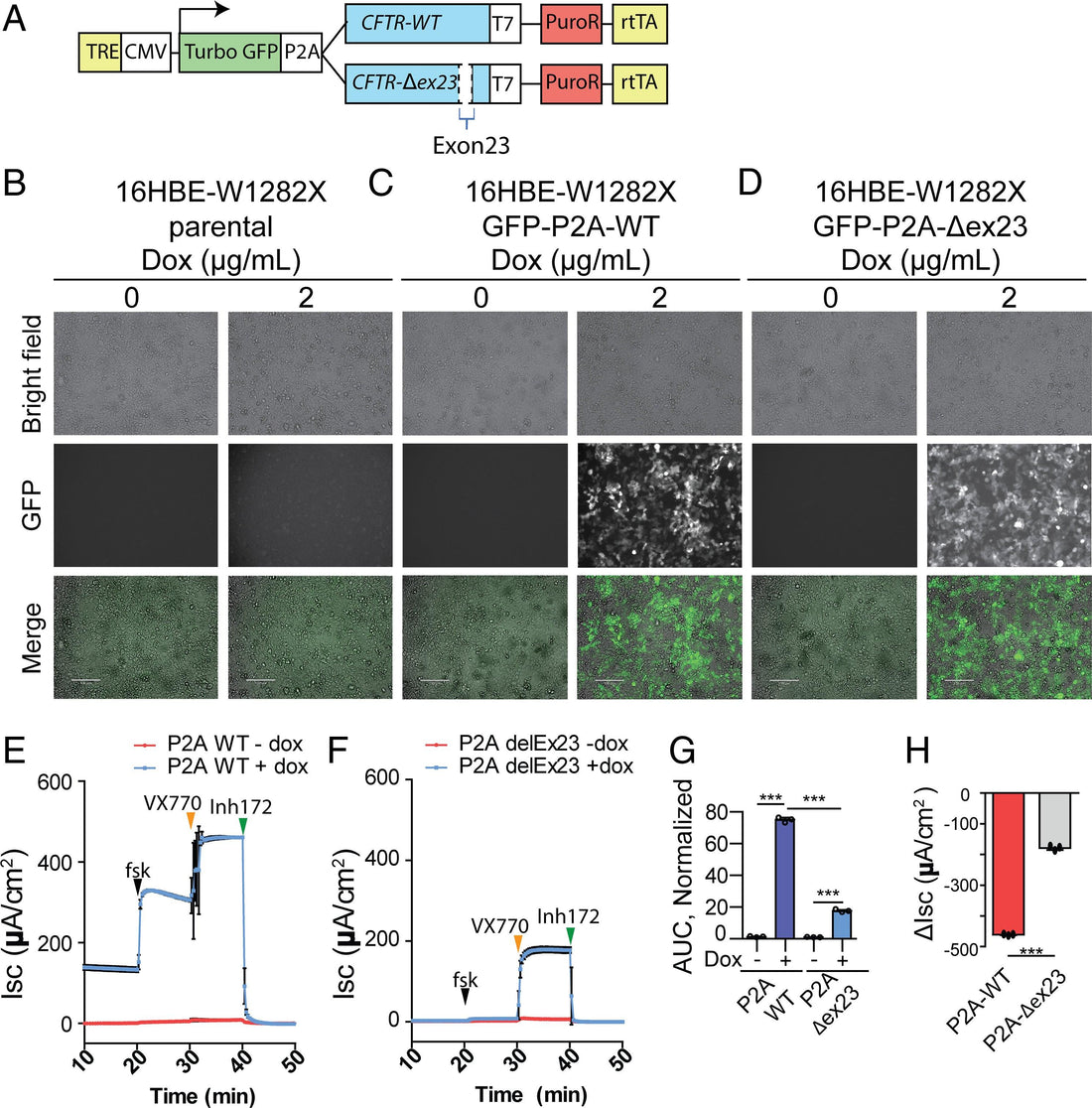
"Die 16HBEge-Zellen wurden als elektrisch dichte Monoschicht auf Snapwell-Filterträgern (Corning, 3801) gezüchtet, wie beschrieben ( 38 ), und sowohl Serosal- als auch Mukosalmembranen wurden vor den Tests 4 Tage lang den ASOs und 24 Stunden lang den CFTR-Korrektoren VX-809, VX-661 oder VX-445 ausgesetzt (Selleckchem, S1565, S7059 bzw. S8851). Die Snapwell-Einsätze wurden in eine Ussing-Kammer (P2302, Physiologic Instruments, Inc.) überführt. Nur die Serosalseite wurde mit 5 ml HEPES [4-(2-Hydroxyethyl)-1-piperazinethansulfonsäure]-gepufferter physiologischer Kochsalzlösung überflutet; auf der Schleimhautseite wurden 5 ml CF-HEPES-gepufferte physiologische Kochsalzlösung (137 mM Na-Gluconat, 4 mM KCl, 1,8 mM CaCl 2 , 1 mM MgCl 2 , 10 mM HEPES und 10 mM Glucose; pH-Wert mit N -Methyl- d -glucamin auf 7,4 eingestellt) verwendet, um einen transepithelialen Chloridionengradienten zu erzeugen. Nach dem Klemmen der transepithelialen Spannung auf 0 mV wurde der Kurzschlussstrom (I SC ) mit einer Epithelspannungsklemme VCC MC6 von Physiologic Instruments gemessen, während die Puffertemperatur bei 37 °C gehalten wurde. Die Basisaktivität wurde 20 Minuten lang aufgezeichnet, bevor Agonisten (Endkonzentrationen: 10 µM Forskolin [Sigma, F6886] und 10 µM VX-770 [Selleckchem, S1144]) und Inhibitoren (Endkonzentration: 20 µM CFTRinh-172 [Sigma, C2992]) nacheinander in 10-Minuten-Intervallen auf sowohl seröse als auch mukosale Oberflächen aufgetragen wurden. Agonisten/Inhibitoren wurden von 200× bis 1.000× Stammlösungen hinzugefügt. Die Datenerfassung wurde mit ACQUIRE & ANALYZE Revision II (Physiologic Instruments) durchgeführt."
DEN GANZEN ARTIKEL FINDEN SIE HIER: https://www.pnas.org/doi/10.1073/pnas.2114858118