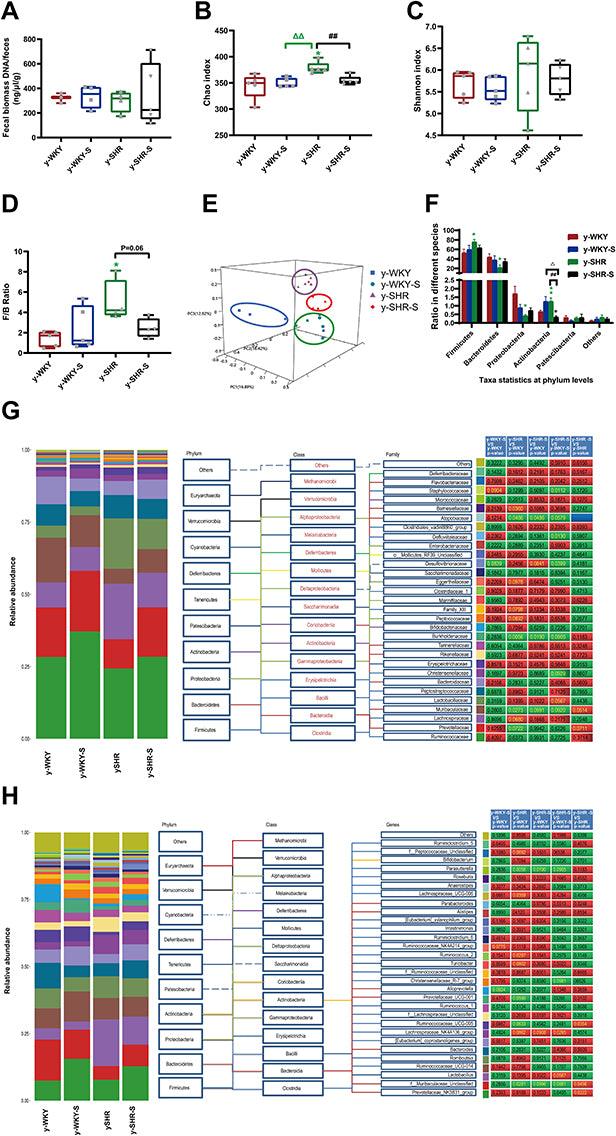
Lo stress da contenimento nei ratti ipertesi attiva i macrofagi intestinali e riduce la barriera intestinale accompagnata da disbiosi della flora intestinale
Valutazione della funzione della barriera del colon
Il tessuto del colon è stato aperto lungo il bordo mesenterico e montato in camere di Ussing (Physiologic Instruments, San Diego, CA) con un'area di esposizione di 0,5 cm2 della superficie del tessuto a 5 mL di VO2 / VCO2 95:5 Krebs-glucosio (10 mM) a 37°C. Dopo l'adattamento per 20 minuti, tetrodotossina (TTX, 0,1 μM, Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, Cina) e indometacina (Indo, 1 μM, Sigma-Aldrich Corp., St. Louis, MO, USA) sono state aggiunte rispettivamente al lato basale per inibire i neuroni enterici e la prostaglandina sintasi e le sezioni hanno lasciato che raggiungessero un livello di stato stazionario per almeno 30 minuti prima dell'inizio di ogni esperimento.
Il pathway paracellulare e il pathway transcellulare sono stati misurati come flusso di FITC-destrano da 4 kDa (FD-4; 0,5 mg/mL; Sigma-Aldrich Corp., St. Louis, MO, USA) e perossidasi di rafano (HRP; 0,5 mg/mL; Beijing Solarbio Science & Technology Co., Ltd., Pechino, Cina), rispettivamente. FD-4 e HRP sono stati aggiunti al lato luminale e i campioni di 400 μL sono stati raccolti dal basolaterale ogni 20 min per 2 h e sostituiti da un volume uguale del tampone corrispondente. La concentrazione di FD-4 è stata misurata utilizzando la fluorescenza a emissione 528 nm ed eccitazione 485 nm. 3,3′,5,5′-tetrametilbenzidina (TMB) è stata utilizzata per rilevare HRP a un'assorbanza di 405 nm. 18
Analisi statistica
I dati sono stati espressi come media±SEM utilizzando Prism 8.0, e il test non parametrico di Wilcoxon (confronti a due gruppi) o il test di Kruskal–Wallis (confronti multi-gruppo) sono stati utilizzati per determinare la significatività tra diversi gruppi di trattamento. N era il numero di animali in ciascun esperimento. Le differenze statistiche tra i gruppi di controllo e di trattamento sono state analizzate utilizzando il test t di Student accoppiato o non accoppiato, quando appropriato.
La correlazione tra le concentrazioni plasmatiche di citochine e ormoni per tutti gli animali y-WKY, y-WKY-S, y-SHR e y-SHR-S è stata determinata utilizzando i coefficienti di correlazione di Pearson e i valori p sono stati confrontati tra i gruppi con il test di Mann-Whitney accoppiato. Le matrici di correlazione sono state inoltre visualizzate come correlogrammi schematici. 19 , 20 Poiché ciascuna di queste citochine e misurazioni ormonali varia ampiamente, il cambiamento multiplo del suo livello rispetto al livello di riferimento è stato utilizzato per la seguente analisi dinamica, la cui dinamica è stata adattata alle pieghe del cambiamento lungo la linea temporale tramite lo smoothing del diagramma di dispersione ponderato localmente (LOWESS). La larghezza di banda (il parametro più importante) determinata per tentativi ed errori è 0,3. Tutte le analisi statistiche sono state eseguite in Stata/SE 12 e nella procedura open source R 3.2 ( https://www.r-project.org/ ). 21