Dalla biopsia al banco di lavoro: guida del medico specialista alla riproducibilità dell'ICM con EasyMount P2400
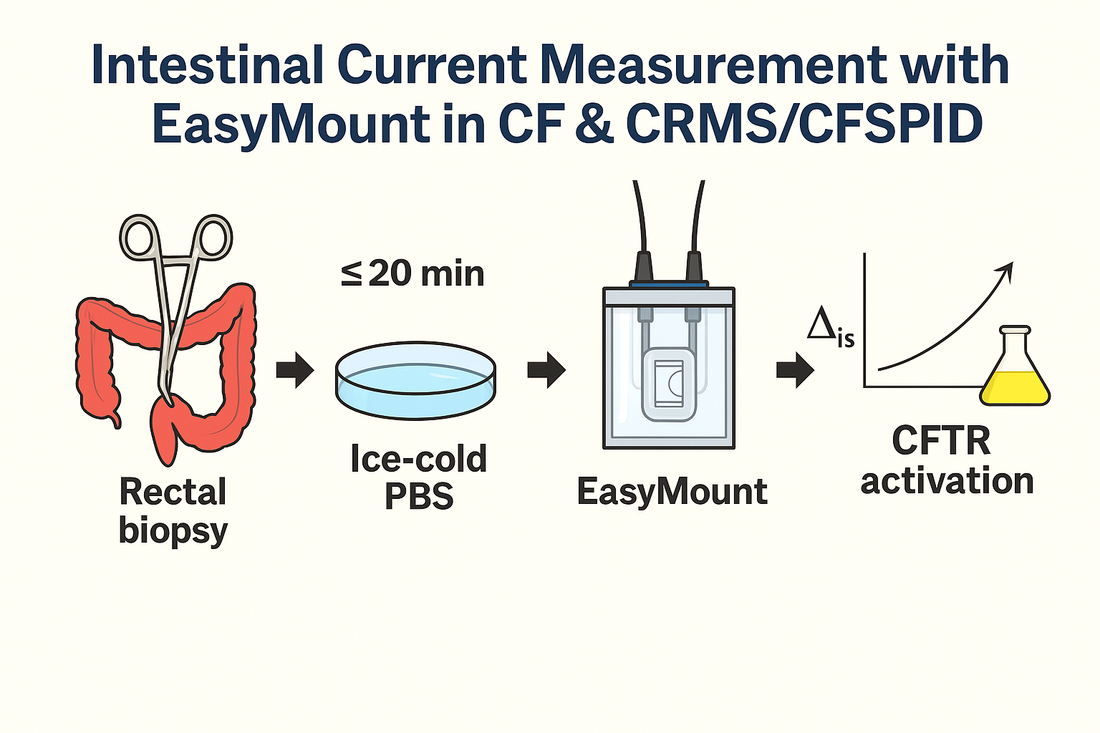
Un nuovo studio pilota polacco mostra come eseguire la misurazione della corrente intestinale (ICM) nelle biopsie rettali utilizzando il sistema di Ussing a basso volume EasyMount® P2400 e il cursore P2407B , offrendo un modello che gli investigatori privati possono seguire per generare letture CFTR ad alta fedeltà in coorti di pazienti con fibrosi cistica, CRMS/CFSPID e pazienti sani. Link all'articolo: https://www.mdpi.com/2077-0383/14/17/6020
Punti chiave (per i responsabili di laboratorio):
-
Gli autori hanno implementato ECFS DNWG SOP v2.7 e hanno segnalato esplicitamente l'hardware EasyMount P2400 + P2407B , eccellente per la riproducibilità del metodo e la trasparenza delle apparecchiature.
-
Il loro flusso di lavoro ha fissato finestre di manipolazione ristrette: 10–20 minuti dalla biopsia al montaggio; pre-incubazione a 37 °C , soglia di vitalità Rt > 10 Ω·cm² ; e una sequenza di stimolanti definita (amiloride → IBMX/forskolina → carbacolo → genisteina → DIDS → istamina).
-
Il ΔIsc cumulativo dopo carbacolo + IBMX/forskolina + istamina ha chiaramente separato la CF dai controlli CRMS/CFSPID e sani, supportando il valore diagnostico dell'ICM quando il cloruro nel sudore è equivoco.

Perché questo è importante adesso - ICM
L'ICM è un biotest ex vivo sensibile della funzione CFTR e integra sempre più il test del sudore e l'NPD quando la diagnosi è incerta, in particolare nei casi di CRMS/CFSPID . Il nuovo studio pilota del Journal of Clinical Medicine (26 agosto 2025) conferma che un setup di Ussing standardizzato e a basso volume può differenziare le coorti in base alla fisiologia (non solo al genotipo), rafforzando le argomentazioni a favore di una più ampia adozione dell'ICM nei programmi clinici e traslazionali.
Fonte: PubMed 40066329
Il progetto ICM riproducibile (direttamente riconducibile alla carta)
Hardware e ambiente
-
Camera: Sistema di Ussing a basso volume EasyMount P2400 (strumenti fisiologici)
-
Slider: P2407B (per piccole biopsie rettali)
-
Temperatura: preincubare le camere a 37 °C
-
Pinza di tensione: misura PD, Isc e Rt per SOP v2.7
Gestione e tempistica dei campioni
-
Raccolta bioptica rettale: ≥3–4 frammenti per soggetto con pinze monouso da 2,3 mm
-
Trasporto: immediatamente in PBS ghiacciato
-
Finestra di montaggio: 10–20 minuti dall'inizio della biopsia all'inizio dell'esperimento
-
Linea di base: dopo circa 5 minuti di pre-incubazione, registrare PD_basal, Isc_basal, Rt_basal
-
Vitalità: includere le risposte solo se il tessuto è intatto e Rt > 10 Ω·cm²
Sequenza di stimoli (mucosale/sierosa come specificato)
-
Amiloride (100 µM) → IBMX (10 µM) + forskolina (100 µM) → carbacolo (100 µM) → genisteina (50 µM) → DIDS (200 µM) → istamina (500 µM)
-
Calcolare la secrezione cumulativa (ad esempio, carbacolo + IBMX/forskolina + istamina) per i confronti di gruppo.
Risultati che l'installazione può risolvere
-
ΔIsc cumulativo (carbacolo + IBMX/forskolina + istamina):
-
CF: 15,32 ± 15,47 µA/cm²
-
CRMS/CFSPID: 86,84 ± 37,84 µA/cm² (p < 0,001 rispetto a CF)
-
Controlli sani: 80,16 ± 48,54 µA/cm² (p = 0,005 vs CF)
→ Implicazione pratica: potenziare gli studi futuri in base alle risposte cumulative; queste combinazioni sono altamente discriminanti per la FC rispetto alla non FC.
-
Trasparenza delle apparecchiature (e dove trovarla)
Lo studio cita esplicitamente il sistema EasyMount P2400 Ussing e lo slider P2407B . Per i laboratori che vogliono aumentare la propria capacità produttiva, questa architettura a basso volume contribuisce a risparmiare reagenti e a stabilizzare i tessuti di piccole dimensioni, vantaggi quando si lavora con biopsie pediatriche o modulatori ad alto costo.
Note di implementazione per i nuovi programmi ICM
-
Adottare la SOP v2.7 di ECFS DNWG e attenersi alle finestre temporali del documento; entrambi sono essenziali per la riproducibilità tra i siti.
-
Standardizzare le soglie di vitalità (ad esempio, Rt > 10 Ω·cm² ) e rifiutare le esecuzioni che non superano il controllo di qualità: questo è stato essenziale per la qualità del set di dati degli autori.
-
Riportare la marca/il modello delle camere e dei cursori nei Metodi: questo documento stabilisce un livello elevato per la divulgazione delle apparecchiature e consente meta-analisi a valle.
Il merito va agli autori
Postek M., Zybert K., Wozniacki L., Woynarowski M., Sands D. Valutazione pilota della misurazione della corrente intestinale in pazienti con fibrosi cistica e CRMS/CFSPID in Polonia. Journal of Clinical Medicine. 2025;14(17):6020. Pubblicato : 26 agosto 2025. DOI: 10.3390/jcm14176020. Ringraziamo il team del Cystic Fibrosis Center di Dziekanów Leśny per aver descritto in dettaglio il protocollo e le scelte hardware. MDPI